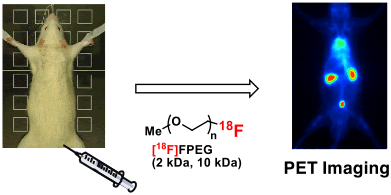
赤井教授は、主に制がん活性を示す多環式芳香族化合物の全合成と、光学活性化合物の不斉合成研究に長年、携わってきた。例えば、これまでに合成した制癌活性抗生物質11-デオキシダウノマイシン、フレデリカマイシンA、γ-ルブロマイシンは世界初の全合成であり、それらの活性評価に基づき各種類縁体を合成し、創薬シーズの創出を目指して研究を展開してきた。また、製薬企業と共同で活性酸素発生抑制作用を有する抗生物質OPC-15161の実用的な合成ルートを開発し、大量生産レベルにスケールアップされ、産学共同研究の成功例として注目された (Figure 1)。
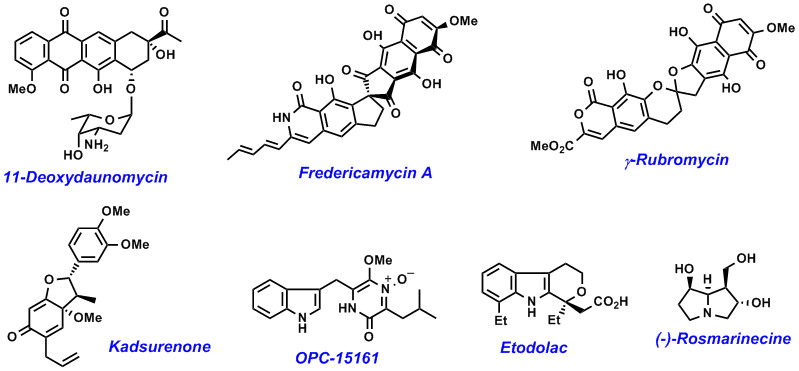
また、1990年代後半より、加水分解酵素と金属触媒を同時に用いる全く新しい不斉合成法の開発にも取り組んでいる。酵素を利用する光学活性化合物の不斉合成法は、常温常圧での高い変換効率と優れたエナンチオ選択性、酵素自身の生分解性などから、光学活性化合物の環境低負荷型合成法として古くから注目されてきたが、未解決の課題も多い。例えば、加水分解酵素リパーゼを用いる速度論的光学分割法は、ラセミ体を各鏡像異性体に分割する優れた方法であるが、それぞれの収率は最大50%であった。赤井らは、メソポーラスシリカの内部にオキソバナジウムを固定化した新規触媒V-MPSを創製し、これとリパーゼを併用することでラセミ体アルコールがほぼ100%の収率で単一の光学活性体に変換される「動的光学分割法」を開発した。本法では、リパーゼによる光学分割によって一方の鏡像体が選択的にエステル化されると同時に、残った他方の鏡像体は、V-MPSの内部でオキソバナジウムによってラセミ化されるために、すべての原料アルコールが1つの光学活性エステルに変換されるという手法である (Scheme 1)。この際、細孔径約4 nmのメソポーラスシリカを用いることで、リパーゼとオキソバナジウムが物理的に隔離され、両触媒が反応して互いを失活することが完全に抑えられた (Scheme 2)。また、反応終了後に、これらの触媒を回収して再利用できる。なお、この研究で開発した新規触媒V-MPS4は和光純薬工業から発売されている。
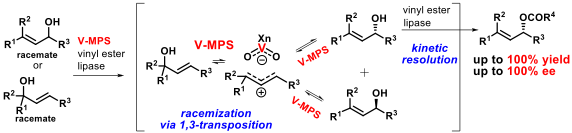
更に、リパーゼ触媒反応で導入したアシル基部分を、そのまま分子内環化反応に利用する「ドミノ型不斉合成」という新規な概念を創生した。本法では、官能基 (FG-1) を有するラセミ体アルコールと、官能基 (FG-2) を有するカルボン酸から、1つのフラスコ内で「カルボン酸の活性化」、「(動的)光学分割」、「分子内環化反応」の3つの反応が連続進行して、多環状分子を不斉合成できる (Scheme 3)。
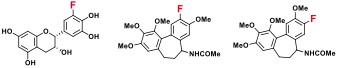
さらに、「含[18F]フッ素長鎖ポリエチレングリコール(FPEG)の合成 (Figure 4)」など、創薬研究や診断薬開発に資する人工の機能性分子合成法の開発にも力を入れている。これらの研究の実用化を目指し、学内外の生物系研究室との共同研究の下、活性評価・構造最適化等を行っている。